 |
| Las ecuaciones de estado describen el comportamiento de un fluido. Imagen de wallpaperflare |
Las ecuaciones de estado son expresiones matemáticas que relacionan variables termodinámicas de estado de un sistema (P, V, T, n). Quizás el ejemplo más común de una ecuación de estado es la ecuación de gases ideales. No obstante, existen varias ecuaciones de estado, las cuales son vitales para el estudio de la termodinámica, la física, la química y la ingeniería. En este artículo definiremos a las ecuaciones de estado, sus aplicaciones y las principales ecuaciones de estado utilizadas en ingeniería química.
Tabla de contenidos
- ✔Definición de ecuaciones de estado
- ✔Usos y aplicaciones de las ecuaciones de estado
- ✔Principales ecuaciones de estado
Definición de ecuaciones de estado
 |
| La ecuación de gas ideal es la ecuación de estado más simple que existe. Imagen de slideplayer |
Desde un punto de vista matemático, se puede decir que las ecuaciones de estado son expresiones matemáticas que permiten modelar el comportamiento de una sustancia. Hay que destacar, que estas expresiones matemáticas deben contar con cierta exactitud, de manera que permitan predecir con un porcentaje de confianza el comportamiento de un fluido en estudio. Con esta idea general, podemos definir a las ecuaciones de estado de la siguiente manera:
Las ecuaciones de estado son aquellas que permiten relacionar las variables de estado de un sistema termodinámico en equilibrio.
Las ecuaciones de estado tienen la siguiente forma general:
Observándose que dicha expresión es función de la presión (P), la temperatura (T) y el volumen (V). También existen otras formas de expresar la forma general de las ecuaciones de estado, las cuales son:
Siendo estas últimas mucho más manejables, ya que sólo dependen de dos variables y no de tres como la forma general.
Las ecuaciones de estado son de gran utilidad, ya que permiten describir las propiedades de los fluidos, mezclas, sólidos e incluso de cuerpos celestes. Cabe destacar, que no existe una única ecuación de estado que permita describir el comportamiento de todas las sustancias para todas las condiciones de presión y temperatura. Cada una de las ecuaciones de estado tiene sus consideraciones y condiciones de uso, es por ello, que se debe elegir con cuidado la ecuación que mejor se adapte a nuestras condiciones de estudio.
Usos y aplicaciones de las ecuaciones de estado
El uso más frecuente que se le da a las ecuaciones de estado es el de predecir el estado termodinámico de los gases. También son ampliamente utilizadas para predecir el comportamiento de los líquidos y los gases, y para estimar el volumen de los sólidos. Las ecuaciones de estado juegan un papel muy importante en la química, específicamente, en la estequiometria. Asimismo, son frecuentemente utilizadas en las siguientes áreas de estudio:- Física
- Química
- Manejo de fluidos
- Materiales de ingeniería
- Instrumentación
- Optimización
- Creación y desarrollo de procesos industriales
Principales ecuaciones de estado
Existen varias ecuaciones de estado, ya que al no existir una única ecuación que permita describir el comportamiento de todas las sustancias en cualquier condición de presión y temperatura, se suelen seleccionar las ecuaciones que mejor se adapten a las condiciones en donde se encuentre el fluido, la mezcla, el sólido o sustancia en estudio. A continuación, describiremos las ecuaciones de estado más utilizadas en el estudio de la ingeniería:Ley de gas ideal
La ley de gas ideal es la ecuación de estado más simple que hay, siendo una de las más utilizadas. Sin embargo, tiene limitaciones ya que sólo puede ser aplicada bajo ciertas condiciones específicas, en las cuales el fluido pueda ser considerado como ideal. Esta ecuación considera el volumen molecular y las fuerzas de atracción-repulsión despreciables, es por esta razón, que no es recomendada para ser utilizada en condiciones de volúmenes pequeños o a bajas temperaturas.La ley de gas ideal es recomendada para ser utilizada a altas temperaturas y presiones bajas. Un criterio muy utilizado para su selección es que la temperatura a utilizar debe ser superior a dos veces la temperatura crítica del compuesto estudiado. La expresión de los gases ideales es la siguiente:
Donde:
- P: Presión.
- v: Volumen específico.
- R: Constante de los gases.
- T: Temperatura.
Factor de compresibilidad
La ecuación de los gases ideales es utilizada para fluidos ideales. El comportamiento de los gases es diferente al ideal a presiones moderadas y altas, es por ello, que se requiere un factor de corrección para las estimaciones volumétricas hechas con la ecuación de gas ideal.Este factor de corrección es conocido como factor de compresibilidad de un gas (Z) y representa que tan alejado se encuentra un gas de la idealidad. Cuando el valor es 1 se considera que el gas es ideal. Si las presiones son bajas, el valor de Z tiende a ser menor a 1. Si las presiones son altas, el valor de Z tiende a ser mayor a 1. El factor de compresibilidad es definido por la siguiente ecuación:
Siendo los mismos componentes de la ecuación de gas ideal. Existen varios métodos para estimar el factor de compresibilidad de un gas (los cuales describiremos en futuros artículos) y uno de los más utilizados para estimar Z es el de Lee-Kesler.
Ecuación virial
Esta ecuación relaciona al factor de compresibilidad con el volumen del gas y unos coeficientes que se encuentran tabulados, de modo, que pueda expresarse Z en función de unas potencias en términos de volumen. La expresión es la siguiente:Donde B, C, D, etc, son coeficientes viriales. Estos coeficientes, por lo general, se encuentran en los textos de termodinámica, suelen estar expresados en función de la temperatura y son estimados de forma experimental a partir de datos P-V-T de gases.
Para presiones bajas de hasta 15 bar, la ecuación virial puede truncarse en el segundo coeficiente (B). Para presiones entre 15 y 50 bar, se recomienda utilizar tres coeficientes para aumentar la precisión del cálculo.
Ecuación de Van Der Waals (VdW)
 |
| Definición de ecuación de Van der Waals. Imagen de pinterest |
Se trata de una ecuación cúbica de estado desarrollada en 1873 por Van der Waals y es la primera ecuación capaz de predecir el comportamiento de gas y líquido, tomando en cuenta las interacciones moleculares atractivas y repulsivas. Fue propuesta para corregir las dos peores suposiciones de la ley de gases ideales: El tamaño molecular infinitesimal y la ausencia de fuerzas intermoleculares. Esta ecuación es considerada histórica y es nombrada en los textos como pionera, sin embargo, hoy en día se considera obsoleta y ha sido reemplazada por ecuaciones más exactas y modernas.
La expresión de la ecuación de Van Der Waals es la siguiente:
Donde:
- P: Presión del gas.
- v: Volumen específico del gas.
- R: Constante de los gases.
- T. Temperatura.
Además, a es la corrección para las fuerzas intermoleculares que se expresa en función de la presión crítica (PC), temperatura crítica (TC) y la constante de los gases de la siguiente forma:
De manera similar, se puede expresar a la corrección por tamaño molecular finito (b):
Ecuación de Redlich-Kwong (RK)
Es otra ecuación cúbica de estado, propuesta en 1949 como una mejora a la ecuación de Van der Waals, incluyendo un factor dependiente de la temperatura. Actualmente, cuenta con mucho interés por su uso, debido a su simpleza. No es recomendable para fase líquida ni para estimar equilibrio líquido-vapor, sin embargo, se recomienda para calcular propiedades de fase gaseosa cuando el cociente entre la presión y la presión crítica es menor a la mitad del cociente entre la temperatura y la temperatura crítica. Esta ecuación es bastante aproximada a presiones elevadas.La ecuación de Redlich-Kwong se expresa de la siguiente manera:
Donde:
- P: Presión del gas.
- v: Volumen específico del gas.
- R: Constante de los gases.
- T. Temperatura.
Además de:
Ecuación de Soave-Redlich-Kwong (SRK)
Es una corrección de la ecuación RK realizada en 1973, donde se sustituyó la raíz cuadrada de la temperatura del segundo término por un valor que se expresa en función de la temperatura y el factor acéntrico, quedando la ecuación de la siguiente manera:Siendo:
w es el factor acéntrico y se encuentra tabulado en diferentes textos de termodinámica. Con esta modificación, Soave obtuvo valores casi idénticos en la estimación de la presión de vapor trabajando con hidrocarburos, dejando atrás la limitación de la ecuación RK, ya que no era efectiva para la estimación de la presión de vapor.
Ecuación de Peng-Robinson (PR)
Esta ecuación cúbica de estado fue propuesta en 1976, y tiene como finalidad expresar los parámetros en función de las propiedades críticas y el factor acéntrico. Ofrece resultados muy parecidos a los obtenidos con la ecuación SRK, sin embargo, es muy recomendada para predecir densidades de fase líquida, especialmente en compuestos apolares, siendo en este sentido superior a la ecuación SRK. La ecuación de Peng-Robinson se expresa de la siguiente manera:Siendo:
Existen muchas otras ecuaciones de estado, algunas muy específicas para condiciones particulares y para diferentes compuestos o sustancias, en este artículo describimos las más comunes y que se pueden encontrar en casi todos los textos de termodinámica.

¿Qué son las ecuaciones de estado? by Ing. Bulmaro Noguera is licensed under a Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional License






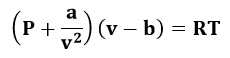

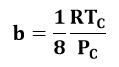




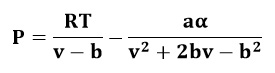











0 Comentarios